THIS IS FEATURED POST 1 TITLE
Lorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempor incididunt ut labore et dolore magna aliqua. Ut enim ad minim veniam


THIS IS FEATURED POST 2 TITLE
Lorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempor incididunt ut labore et dolore magna aliqua. Ut enim ad minim veniam


THIS IS FEATURED POST 3 TITLE
Lorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempor incididunt ut labore et dolore magna aliqua. Ut enim ad minim veniam


THIS IS FEATURED POST 4 TITLE
Lorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempor incididunt ut labore et dolore magna aliqua. Ut enim ad minim veniam

Nabi adam
Unknown | 02:48 |
Nabi Adam, dan misteri telapak kaki 200 juta tahun yang lalu ?
Di dekat kota Mpaluzi (Afrika Selatan) dihebohkan dengan penemuan telapak kaki manusia, yang berukuran panjang sekitar 4 feet (121,92 cm).
Kehebohan itu, semakin berlajut setelah mengetahui umur dari telapak kaki tersebut, yang diperkirakan telah berusia sekitar 200 juta tahun yang lalu.
Sumber : consciouslifenews.com
Era Mesozoikum
Berdasarkan ilmu geologi, masa 200 juta tahun yang lalu disebut era Mesozoikum (65 juta – 251 juta tahun yang lalu).
Era Mesozoikum ditandai dengan aktivitas tektonik, iklim, dan evolusi.Benua-benua secara perlahan mengalami pergeseran dari saling menyatu satu sama lain menjadi seperti keadaannya saat ini.Pergeseran ini menimbulkan spesiasi dan berbagai perkembangan evolusi penting lainnya. Iklim hangat yang terjadi sepanjang periode juga memegang peranan penting bagi evolusi dan diversifikasi spesies hewan baru. Pada akhir zaman ini, dasar-dasar kehidupan modern terbentuk. Pada akhir era Mesozoikum, bumi mulai dihuni makhluk-makhluk mamalia.
Jejak kaki Nabi Adam ?
Muncul berbagai spekulasi atas penemuan jejak kaki di Afrika Selatan ini. Mungkinkah jejak tersebut adalah jejak Nabi Adam, yang disebut-sebut di dalam Al Qur’an sebagai manusia pertama.
Untuk menjawab itu, kita bisa memulai dengan mengetahui berapa sesungguhnya tinggi manusia, yang jejaknya di temukan di Afrika Selatan itu.
Berdasarkan penelitian, ukuran telapak kaki manusia, secara normal adalah 15% dari ukuran tingginya. Dengan berdasarkan penelitian ini, bisa kita ambil kesimpulan, tinggi manusia 200 juta tahun tersebut sekitar 812,8 cm atau 8,128 m.
Hasil ini memberi bukti, jejak kaki ini bukanlah jejak kaki manusia generasi Nabi Adam. Hal ini dikarenakan berdasarkan hadits, tinggi Nabi Adam lebih dari 8 meter.
Nabi Adam memiliki tinggi 60 Hasta” (Hadits Bukhari Vol.IV No.543)… Dimana 60 Hasta = 90 Kaki = 30 Meter.
Misteri Jejak Kaki
Misteri jejak kaki di Afrika Selatan ini, bisa memunculkan beberapa kemungkinan :
1. Jejak kaki tersebut, adalah jejak kaki Bangsa Nisnas, yang merupakan makhluk berakalsebelum era Nabi Adam di Bumi. Keberadaan makhluk ini dikarenakan bumi sendiri, masih belum siap ditinggali manusia.
2. Jejak kaki tersebut, adalah jejak kaki bani Adam. Muncul pertanyaan, bagaimana tinggi generasi Nabi Adam yang 30 meter, ketika di bumi berubah menjadi 8 meter ?
Yang mendukung teori ini, akan ber-dalil bahwa Tinggi Adam 30 meter itu, adalah ukuran tubuhnya ketika di Jannah. Sementara ketika diturunkan di bumi, struktur tubuhnyaberadabtasi dengan keadaan asmosfir dan gravitasi bumi.
Dan ketika Bani Adam, hidup di Surga, maka tubuh manusia akan dimodifikasi ke bentuk awalnya, yaitu setinggi 60 hasta.
Sebagaimana hadits :إِنَّ أَوَّلَ زُمْرَةٍ يَدْخُلُوْنَ الْجَنَّةَ عَلَى صُوْرَةِ الْقَمَرِ لَيْلَةَ الْبَدْرِ ثُمَّ الَّذِيْنَ يَلُوْنَهُمْ عَلَى أَشَدِّ كَوْكَبٍ دُرِّيٍّ فِي السَّمَاءِ إِضَاءَةً لاَ يَبُوْلُوْنَ وَلاَ يَتَغَوَّطُوْنَ وَلاَ يَتْفُلُوْنَ وَلاَ يَمْتَخِطُوْنَ … وَأَزْوَاجُهُمْ الْحُوْرُ الْعِيْنُ عَلَى خُلُقِ رَجُلٍ وَاحِدٍ عَلَى صُوْرَةِ أَبِيْهِمْ آدَمَ سِتُّوْنَ ذِرَاعًا فِي السَّمَاءِ“Sesungguhnya rombongan pertama yang masuk surga seperti rembulan yang bersinar di malam purnama, kemudian rombongan berikutnya seperti bintang yang paling terang di langit, mereka tidak buang air kecil, tidak buang air besar, tidak membuang ludah, tidak beringus….istri-istri mereka adalah para bidadari, mereka semua dalam satu perangai, rupa mereka semua seperti rupa ayah mereka Nabi Adam, yang tingginya 60 hasta menjulang ke langit” (HR Al-Bukhari 3327)
3. Bagi yang meyakini, bumi lebih dari satu akan berpendapat, jejak kaki itu adalah Bani Adam, yaitu merupakan keturunan dari Adam yang berada di bumi yang lain.
Dan jarak antara Bani Adam itu, dengan Nabi Adam, sangat lama mungkin mencapaimiliaran tahun. Jadi wajar jika kemudian, manusia yang menjadi penghuni bumi yang ada ditata surya kita ini, memiliki tubuh yang tidak terlalu tinggi.
Adapun dalil, yang mereka gunakan adalah pendapat dari Ibnu Abbas ra.
Di riwayatkan oleh Al Hakim di Mustadrok (3781) dan darinya Al Baihaqi di Asma was Shifat (831)أخبرنا أحمد بن يعقوب الثقفي ، ثنا عبيد بن غنام النخعي ، أنبأ علي بن حكيم ، ثنا شريك ، عن عطاء بن السائب ، عن أبي الضحى ، عن ابن عباس رضي الله عنهما ، أنه قال : ﴿ الله الذي خلق سبع سماوات ومن الأرض مثلهن ﴾ قال : « سبع أرضين في كل أرض نبي كنبيكم وآدم كآدم ، ونوح كنوح ، وإبراهيم كإبراهيم ، وعيسى كعيسى » هذا حديث صحيح الإسناد ولم يخرجاهTelah bercerita kepada kami Ahmad bin Ya’qub Atsaqofi, bercerita kepada kami ‘Ubaid bin Ghonaam An Nakho’i menceritakan kepada kami ‘Ali bin Hakiim, bercerita kepada kami Syariik, dari ‘Atho bin Saaib, dari Abi Dhuha, dari Ibnu Abbas bahwa dia berkata:﴿اللَّهُ الَّذِي خَلَقَ سَبْعَ سَمَاوَاتٍ وَمِنَ الأرْضِ مِثْلَهُنَّ ﴾﴾Allah-lah yang menciptakan tujuh langit dan seperti itu pula bumi.) beliau berkata: tujuh buah bumi, pada setiap bumi nabi seperti nabi kalian, dan Adam seperti Adam, Nuh seperti Nuh, Ibrohiim seperti Ibrohiim, ‘Isa seperti ‘Isa.
4. Ada juga pendapat yang mempercayai jejak kaki tersebut hanyalah rekayasa belaka, atau paling banter hanya jejak hewan purbakala yang mirip dengan telapak kaki manusia.
Kelompok ini lebih percaya kepada hasil penelitian ahli purbakala yang meng-indikasikan kemunculan manusia modern, terjadi pada sekitar 200.000 tahun yang lalu. Selain itu, pendapat para ahli purbakala ini, juga didukung dari hasil penyelusuran DNA, yang menyimpulkan ibu dari seluruh manusia yang ada sekarang, berasal dari masa sekitar 145.000 tahun yang silam.Dalam masalah manusia raksasa, mereka meyakini hanyalah bentuk daripengecualian belaka, dan menurut mereka dari masa 200.000 tahun yang silam, sampai sekarang, tinggi manusia tidaklah berubah secara signifikan, sebagaimana temuan ahli purbakala.
Berkenaan dengan hadits Rasulullah, tentang Nabi Adam yang memiliki tinggi 30 meter, menurut mereka adalah bentuk tubuh manusia nanti apabila di surga, jadi tidak ada kaitannya dengan kehidupan manusia di dunia fana.
WaLlahu a’lamu bishshawab
http://kanzunqalam.wordpress.com/2013/02/14/nabi-adam-dan-misteri-telapak-kaki-200-juta-tahun-yang-lalu/
Al fathihah
Unknown | 01:52 |
Bahasa Surat Ayat
|
bismi allaahi alrrahmaani alrrahiimi
|
[1:1] Dengan menyebut nama Allah Yang Maha Pemurah lagi Maha Penyayang.1
|
alhamdu lillaahi rabbi al'aalamiina
|
alrrahmaani alrrahiimi
|
[1:3] Maha Pemurah lagi Maha Penyayang.
|
maaliki yawmi alddiini
|
iyyaaka na'budu wa-iyyaaka nasta'iinu
|
ihdinaa alshshiraatha almustaqiima
|
[1:6] Tunjukilah8 kami jalan yang lurus,
|
shiraatha alladziina an'amta 'alayhim ghayri almaghdhuubi 'alayhim walaa aldhdhaalliina
|
[1:7] (yaitu) Jalan orang-orang yang telah Engkau beri ni'mat kepada mereka; bukan (jalan) mereka yang dimurkai dan bukan (pula jalan) mereka yang sesat.9
|
| Halaman : |
|
Bentuk Molekul, Teori Domain Elektron, Tolakan Pasangan, Notasi VSEPR, Hibridisasi,
Unknown | 06:55 |
Bentuk Molekul, Teori Domain Elektron, Tolakan Pasangan, Notasi VSEPR, Hibridisasi,
Teori Domain Elektron, Tolakan Pasangan, Notasi VSEPR dan Bentuk Molekul, Hibridisasi, Contoh Soal, Pembahasan, Kimia - Domain berarti wilayah atau daerah. Domain elektron berarti suatu wilayah yang ditempati oleh elektron. Adapun elektron yang dimaksud di sini adalah elektron dari atom-atom pembentuk molekul, meliputi pasangan elektron bebas (PEB) dan pasangan elektron ikatan (PEI). Sebuah molekul memiliki bentuk atau struktur yang berbeda dengan struktur molekul lain. Bentuk molekul berarti cara atom tersusun di dalam ruang. Bentuk molekul ini banyak memengaruhi sifat-sifat fisis dan kimia dari molekul tersebut, khususnya dalam reaksi kimia. Ketika dua molekul dicampurkan untuk bereaksi, ada kemungkinan reaksi tidak berhasil dikarenakan struktur tiga dimensi dan orientasi relatif molekul-molekul tersebut tidak tepat. Dalam reaksi biologi, terutama pada obat dan aktivitas enzim, struktur molekul sangat penting untuk mengetahui kecocokan antara bentuk molekul dengan tapak atau membran yang dipakai. (Baca juga : Gaya Antar Molekul)
Bentuk molekul adalah gambaran tentang susunan atom-atom dalam molekul berdasarkan susunan ruang pasangan elektron dalam atom atau molekul, baik pasangan elektron yang bebas maupun yang berikatan.
Bentuk suatu molekul dapat diperkirakan berdasarkan teori tolakan pasangan elektron maupun teori hibridisasi. Bagaimanakah bentuk suatu molekul berdasarkan teori tersebut? Perhatikan uraian berikut.
1. Teori Tolakan Pasangan Elektron
Konsep yang dapat menjelaskan bentuk geometri (struktur ruang) molekul dengan pendekatan yang tepat adalah Teori Tolakan Pasangan Elektron Valensi (Valence Shell Electron Pair Repulsion = VSEPR). Teori ini disebut juga sebagai Teori Domain Elektron. Teori Domain dapat menjelaskan ikatan antar atom dari PEB dan PEI yang kemudian dapat mempengaruhi bentuk molekul. Dalam teori ini dinyatakan bahwa "pasangan elektron terikat dan pasangan elektron bebas, yang secara kovalen digunakan bersama-sama di antara atom akan saling menolak, sehingga pasangan itu akan menempatkan diri sejauh-jauhnya untuk meminimalkan tolakan". Teori VSEPR pertama kali dikembangkan oleh ahli kimia dari Kanada, R.J. Gillespie (1957). Bentuk molekul dan strukturnya dapat diramalkan dengan tepat melalui Struktur Lewis. Struktur ini dapat menggambarkan bagaimana elektron tersusun pada suatu atom yang berikatan. Sebagat contoh adalah ikatan kovalen pada molekul HC1 (Gambar 1). Struktur Lewis juga dapat menggambarkan jumlah pasangan elektron bebas dan jumlah pas-angan elektron ikatan yang berada di sekitar atom pusat.
 |
| Gambar 1. PEI dan PEB pada ikatan kovalen molekul HCl. |
Teori VSEPR tidak menggunakan orbital atom dalam meramalkan bentuk molekul, tetapi menggunakan titik elektron suatu atom. Jika suatu atom bereaksi, maka elektron pada kulit terluar (elektron valensi) akan bcrhubungan langsung terlebih dahulu. Elektron valensi akan menentu-kan bagaimana suatu ikatan dapat terjadi.
Teori VSEPR menjelaskan terjadinya gaya tolak-menolak antara pasangan-pasangan elektron pada kulit terluar atom pusat.
Masih ingatkah kalian dcngan jumlah elektron yang mcncmpati suatu orbital? Apakah yang dimaksud dengan rumus duplet dan rumus oktet?
Pada setiap orbital terdapat sejumlah elektron. Ikatan antar atom terjadi karena kecenderungan atom untuk memenuhi rumus duplet dan rumus oktet. Duplet berarti mcmiliki 2 elektron, scdangkan oktrt menandakan suatu atom memiliki 8 elektron. Bagaimana cara meramalkan bentuk molekul dengan titik elektron? Pengaturan pasangan elektron di sekitar atom sedemikian rupa sehingga tolakan di antara pasangan elektron itu minimum. Tolakan minimum tcrjadi bila elektron terletak pada bagian yang saling bcrlawanan terhadap inti. Perhatikan molekul BeC12 pada Gambar 2.
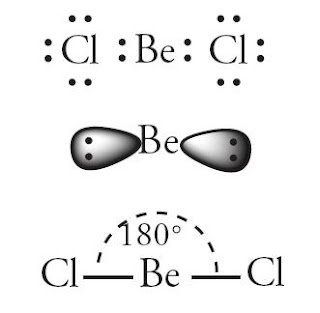 |
| Gambar 2. Bentuk molekul BeC12 berupa linear. |
Terdapat 2 elektron yang terletak berlawanan pada orbital berupa balon terpilin. Molekul BeC12 berbentuk linear dengan sudut 1800. Bagaimana dengan bentuk molekul lain, semisal SO2 dan BC13? Perhatikan Gambar 3. dan 4.
 |
| Gambar 3. Bentuk molekul SO2 berupa V. |
lkatan kovalen adalah ikatan yang terjadi karena pemilikan bersama pasangan elektron berikatan yang merupakan sum-bangan dari kedua atom atau salah satunya.
 |
| Gambar 4. Bentuk molekul BC13 berupa segitiga datar. |
Teori VSEPR berhasil menjelaskan bentuk molekul. Ketepatan daya prediksi teori VSEPR relatif sangat tinggi, khususnya untuk molekul-molekul yang pusatnya atom non-logam. (www.unibookstore.stie-mce.ac.id)
Mengapa struktur SO2 berbeda dengan struktur BeC12? Mengapa pula berbeda dengan struktur BC13. Penjelasan berikut akan memberikan jawabannya.
Tolakan minimum didapat dengan meletakkan elektron pada bagian yang berlawanan. Tolakan minimum pada mulekul BC13 dengan atom B sebagai atom pusat didapat dengan bentuk segitiga. Adapun pada molekul SO2 terdapat 3 kelompok elektron, yang salah satunya adalah PEB dari atom S. Adanya elektron bebas ini akan mendesak atau mendorong elekron ikatan untuk saling berdesakan, sehingga bentuk molekul menjadi bentuk V.
Urutan tolak-menolak antara pasangan elektron pada atom pusat dapat diurutkan sebagai: PEB-PEB > PEI-PEB > PEI-PEI.
PEB mempunyai gaya tolak-menolak sejauh mungkin sehingga tolakannya minimum. Perbedaan kekuatan tolakan PEB dan PEI menyebabkan penyimpangan dalam susunan ruang elektron dari bentuk molekul yang seharusnya.
Apabila pada molekul BC12 atom pusat B dinotasikan dengan M, sedangkan ikatan dengan Cl yang terjadi dengan 2 pasang elektron ikatan dinotasikan dengan X2, maka molekul BC12 dan molekul sejenis dinotasikan dengan MX2. SO2 dinotasikan dengan MX2E, dengan E menunjukkan jumlah pasangan pa sangan elektron bebas. Notasi semacam ini disebut sebagai notasi VSEPR. Perhatikan notasi VSEPR dan bentuk molekul beberapa senyawa pada Tabel 1.
Tabel 1. Notasi VSEPR Molekul
Jumlah
Domain
|
Jumlah
PEI
|
Jumlah
PEB
|
Notasi
VSEPR
|
Contoh
Molekul
|
2
|
2
|
-
|
AX2
|
BeCl2
|
3
|
3
|
-
|
AX3
|
BCl3
|
3
|
2
|
1
|
AX2E
|
SO2
|
4
|
4
|
0
|
AX4
|
CH4
|
4
|
3
|
1
|
AX3E
|
NH3
|
4
|
4
|
2
|
AX2E3
|
H2O
|
5
|
5
|
0
|
AX5
|
PCl5
|
5
|
4
|
1
|
AX4E
|
TeCl4
|
5
|
3
|
2
|
AX3E2
|
ClF3
|
5
|
2
|
3
|
AX2E3
|
XeF2
|
6
|
6
|
0
|
AX6
|
SF6
|
6
|
5
|
1
|
AX5E
|
IF5
|
6
|
4
|
2
|
AX4E2
|
XeF4
|
Tabel 2. Bentuk Molekul
Contoh
Molekul
|
Bentuk Molekul
|
BeCl2
|
|
BCl3
|
|
SO2
|
|
CH4
|
|
NH3
|
|
H2O
|
|
PCl5
|
|
TeCl4
|
|
ClF3
|
|
XeF2
|
|
SF6
|
|
IF5
|
|
XeF4
|
|
Penentuan bentuk molekul dari beberapa molekul dapat lebih jelas jika kalian perhatikan contoh soal berikut.
Contoh Soal :
Tentukan PEB, PEI, serta notasi VSEPR dan bentuk molekul dari:
a. CH4
b. NH3
Jawaban :
a. CH4
Atom pusat C memiliki nomor atom 6, dengan konfigurasi elektron: 1s2, 2s2, 2p2, sehingga mempunyai 4 elektron valensi. Atom C mengikat 4 atom H yang masing-masing memiliki 1 elektron tunggal, sehingga:
Jumlah atom
|
:
|
C = 4 x 1 = 4 elektron
| |
H = 4 x 1 = 4 elektron
|
+
| ||
8 elektron
|
Dari 8 elektron (4 pasang elektron) tersebut, keempatnya merupakan PEI (Pasangan Elektron Ikatan) dengan 1 elekton atom C berikatan dengan 1 elektron atom H. Berdasarkan data pada Tabel 1, kita dapat menyimpulkan bahwa molekul CH4 dengan notasi VSEPR AX4, memiliki bentuk molekul tetrahedron (tetrahedral).
 |
| Gambar 5. Bentuk molekul CH4. |
b. NH3
Atom pusat N memiliki nomor atom 7, dengan konfigurasi elektron: 1s2, 2s2, 2p3, sehingga memiliki 5 elektron valensi. Atom C mengikat 3 atom H yang masing-masing memiliki 1 elektron tunggal, sehingga:
Jumlah atom
|
:
|
N = 5 x 1 = 4 elektron
| |
H = 3 x 1 = 4 elektron
|
+
| ||
8 elektron
|
Dari 8 elektron (4 pasang elektron) tersebut, 3 pasang merupakan PEI (3 elekton atom N berikatan dengan 3 elektron atom H), dan sepasang elektron merupakan PEB (Pasangan Elektron Bebas). Berdasarkan data pada Tabel 1, kita dapat menyimpulkan bahwa molekul NH3 dengan notasi VSEPR AX3E memiliki bentuk molekul piramida trigonal.
Cara Menentukan Bentuk Molekul Berdasarkan Teori VSEPR
- Tentukan atom pusatnya.
- Cari tahu nomor atomnya dan buat konfigurasi elektronnya.
- Tentukan jumlah elektron valensinya.
- Tentukan jumlah domain elektron dari atom lain yang berikatan (ligan).
- Jumlahkan elektron dari semua atom.
- Bagilah dua untuk mendapatkan jumlah pasangan elektron.
- Tentukan PEI berdasarkan jumlah atom yang terikat pada atom pusat, sisanya merupakan PEB.
- Tentukan notasi VSEPR dan bentuk molekul berdasarkan jumlah PEB dan PEI (lihat tabel 1. sebagai acuan).
2. Bentuk Molekul Berdasarkan Teori Hibridisasi
Orbital hibrida adalah orbital yang terbentuk sebagai hasil penggabungan (hibridisasi) 2 atau lebih orbital atom. Sebagai contoh, sebuah atom C yang pada kulit valensinya memiliki 3 orbital, yaitu 2s2, 2px1, 2pyl, dan sebuah orbital kosong, 2pz°. Keempat orbital ini dapat berhibridisasi membentuk empat orbital hibrida sp3. Masing-masing orbital hibrid dari atom C inilah yang digunakan untuk berikatan dengan 4 orbital s dari 4 atom H membentuk sebuah molekul CH4 Keempat ikatan ini saling mem-bentuk sudut tetrahedron. Lebih jelasnya, lihatlah Gambar 6.
 |
| Gambar 6. Bentuk molekul CH4 berdasarkan teori hibridisasi. |
Dalam molekul C2H4, 1 orbital s dan 2 orbital p dalam scbuah atom C dapat membentuk 2 orbital hibrida sp2 dengan sudut 120°, sedangkan dalam molekul C2H2, 1 orbital s dan 2 orbital p dapat membentuk 1 orbital hibrid sp (linear). Perhatikan contoh molekul NH3 pada Gambar 7.
 |
| Gambar 7. Molekul NH3. |
Bila bentuk molekul didasarkan pada tolakan pasangan elektron, NH3 dengan notasi VSEPR AX3 memiliki bentuk molekul piramida trigonal. Bagaimana bentuk molekulnya berdasarkan hibridisasi orbital?
Atom N memiliki nomor atom 7 dan konfigurasi elektronnya 1s2, 2s2, 2px1, 2py1, dan 2pz1. Karena memiliki 3 atom tunggal pada orbital 2p, maka atom N dapat membentuk 3 ikatan kovalen dengan atom H secara ekuivalen, sehingga sudut N-H-N sebesar 107 C. Mengingat sudut ikatan mendekati sudut tetrahedron (sp3), maka untuk menambahkan 1 orbital lagi dipakai orbital 2s2. Akhirnya, atom N menggunakan 4 orbital atom untuk berikatan, 1 orbital dengan elektron berpasangan dan 3 orbital lain dengan elektron tunggal. Perhatikan Gambar 8. agar lebih jelas.
 |
| Gambar 8. Bentuk molekul berdasarkan hibridisasi dari NH3. |
Sumber : http://perpustakaancyber.blogspot.com/2013/06/bentuk-molekul-teori-domain-elektron.html#ixzz2fLYJUpKB
Subscribe to:
Posts (Atom)